AEX
13.6800


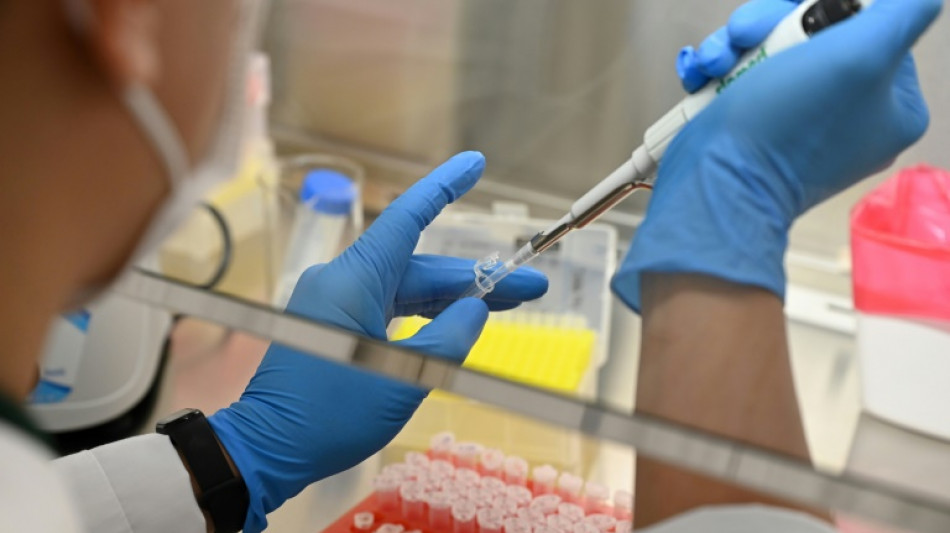
Le premier traitement utilisant les ciseaux moléculaires Crispr dans une maladie du sang a récemment été autorisé dans plusieurs pays: cette avancée "ouvre la porte" à d'autres thérapies s'appuyant sur le génome --l'ensemble des gènes -- pour combattre des pathologies complexes.
"Tout le monde s'intéresse à la façon dont les sociétés pharmaceutiques cherchent à utiliser" la technique des ciseaux moléculaires et autres processus de modification génétique des cellules, souligne Clarivate, une société spécialisée dans les données scientifiques.
Le traitement qui a été autorisé début février par Bruxelles --et qui l'est déjà dans d'autres pays-- se nomme Casgevy. Il s'appuie sur la technologie Crispr (prononcée "crispeur"), un outil révolutionnaire inventé en 2012 qui modifie le gène défaillant du malade. Il avait valu le prix Nobel de chimie à la Française Emmanuelle Charpentier et à l'Américaine Jennifer Doudna en 2020.
Casgevy a été développé par les laboratoires américain Vertex Pharmaceuticals et suisso-américain Crispr Therapeutics pour soigner les patients atteints de maladies héréditaires rares du sang, la drépanocytose et la bêta-thalassémie.
Les autorités sanitaires britanniques ont été les premières à l'approuver pour ces deux maladies, en novembre 2023. Leurs homologues américaine, européenne et l'Arabie Saoudite leur ont emboîté le pas cet hiver. La Commission européenne a publié le 12 février sa décision d'autorisation de mise sur le marché.
- Des traitements coûteux-
Ces autorisations "ouvrent la porte à d'autres applications des thérapies Crispr dans le futur pour guérir potentiellement de nombreuses maladies génétiques", estime la généticienne britannique Kay Davies, de l'Université d'Oxford.
Mais vu le coût de ces thérapies --2,2 millions de dollars par patient pour Casgevy pris en une seule dose --, l'enjeu sera de les rendre accessibles à l'échelle mondiale, ajoute-t-elle, comme nombre d'autres scientifiques.
"Ce traitement ne va pas pouvoir approvisionner les pays à revenu faible et intermédiaire", abonde le Pr Simon Waddington, spécialisé en thérapie génique à University College London (UCL). Ce n'est "pas un médicament qui peut être facilement injecté ou pris sous forme de pilule".
Les cellules du patient sont modifiées grâce à Crispr puis transplantées chez le patient.
"On reste prudent sur les effets à long terme de cette technologie qui en est à ses débuts", souligne auprès de l'AFP Marina Cavazzana, médecin à l'hôpital Necker à Paris et chercheuse de renom en thérapie génique.
Dans cette "révolution des outils génétiques mis à disposition pour soigner les malades, d'autres techniques apparaissent en utilisant des +Crispr améliorés+" pour corriger des maladies héréditaires ou acquises, jusqu'aux cancers, ajoute-t-elle.
- 2.000 thérapies géniques -
Crispr n’est pas seulement un moyen de modifier l’ADN (l'ensemble des caractères héréditaires d'une cellule) des patients : il peut être utilisé pour tous les organismes vivants --bactéries, plantes, animaux-- et aider au diagnostic des maladies, déclare à l'AFP Mario Amendola, chargé de recherche au Généthon.
D'autres applications sont au stade de la recherche, comme par exemple la possibilité de "modifier l'ADN des animaux pour rendre des organes compatibles" avec l'humain, ou "modifier l’ADN des moustiques pour éradiquer le paludisme", ajoute-t-il.
En 2019, huit thérapies géniques étaient disponibles dans le monde pour soigner des patients.
En 2023, 27 thérapies géniques (incluant les thérapies cellulaires génétiquement modifiées) étaient approuvées et environ 2.000 en cours de développement, selon des chiffres publiés en octobre 2023 par Citeline, société de service et conseil pharmaceutique.
La valeur de ce marché pourrait atteindre 80 milliards de dollars d'ici à 2029, évalue GlobalData, société de données et d'analyses.
Mais "88% des traitements liés à la technique Crispr sont à des stades précoces de développement et il est donc peu probable qu'on assiste à une autre approbation dans un futur proche", analyse Jasper Morley, expert chez GlobalData.
Les thérapies géniques nécessitent des investissements très importants. "Leurs coûts colossaux de développement et de production, le risque d'essais cliniques infructueux et les pressions sur les prix et sur les remboursements vont continuer à peser sur ces innovations", ajoute le cabinet d'analyses.
G.George--TFWP